近日,南华大学伍代朝教授团队在Nature Communications上发表题为“Structuralinsights into clonal restriction and diversity in T cell recognition oftwo immunodominant SARS-CoV-2 nucleocapsid epitopes”的研究论文,为理解T细胞对新冠病毒变体和冠状病毒同源核衣壳表位的识别提供了框架。南华大学为论文第一完成单位。
CD8 T细胞在清除新冠病毒感染和形成长期记忆中发挥至关重要的作用。新冠病毒核衣壳蛋白远比刺突蛋白保守,是激活细胞毒性CD8 T细胞的广谱疫苗理想靶点。理解T细胞对新冠病毒核衣壳表位的免疫识别机制是研发广谱长效疫苗的关键。

该团队前期研究发现,核衣壳LLL表位引发了强烈地克隆限制性T细胞应答,其TCR库的显著特征是缺乏序列多样性,超过50%使用了几乎相同的TRAV12-1/12-2基因片段。该研究进一步通过解析克隆限制性TCR识别核衣壳表位LLL-MHC的复合物晶体结构,发现克隆限制性TCR采用高度相似的方式结合LLL-MHC,这种高度相似的几何构象主要归因于Vα结构域在识别过程中的主导作用。特别是种系编码CDR1α环Gln31和Ser32残基作为关键“锚定点”与LLL-MHC形成保守的相互作用网络,揭示了LLL表位特异性TCR基因选择偏好性的机制。而LLL表位Q229K突变与克隆限制性TCR的CDR3b形成空间位阻,且自由能升高不利于TCR识别,导致LLL表位特异性T细胞库不能有效清除Q229K突变株,从而揭示携带Q229K突变的JN.1、BA.2.86等变异株逃逸的机制。
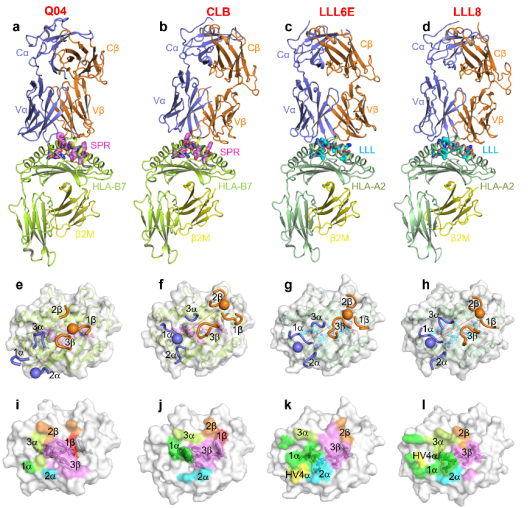
TCR识别LLL和SPR表位的复合物结构
与之相反,SPR表位引发了克隆多样性T细胞应答,其TCR采用了多种不同的α/β链配对组合。该研究同时解析了多克隆TCR识别核衣壳表位SPR-MHC的复合物结构,发现SPR表位特异性TCR采用不同结构模式识别该表位。其中Q04TCR识别SPR肽主要依赖于CDR3β与CDR3α,而CLBTCR与SPR肽的相互作用主要由CDR3β与CDR1α介导。SPR表位诱导T细胞克隆库的多样性有助于增强T细胞应答的功能异质性,并降低病毒逃逸风险。并且通过表面等离子共振发现TCR Q04和CLB能交叉识别OC43、HKU1、SARS-CoV-1同源肽。阐明SPR表位具有介导广谱、长效免疫的潜力。
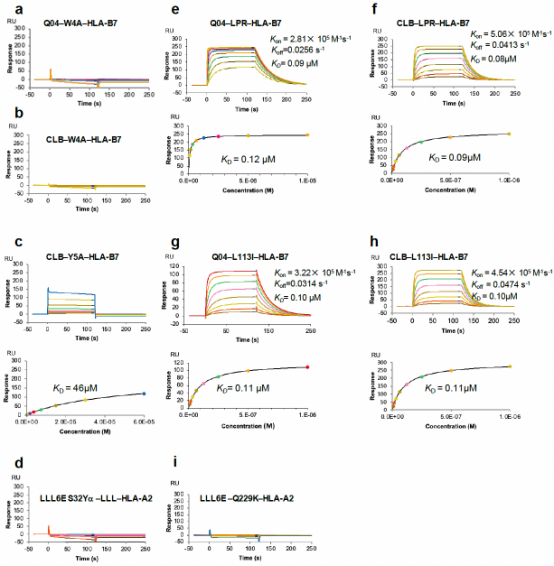
TCR识别核衣壳表位的亲和力分析
该研究系统探讨了引发克隆限制性T细胞应答的核衣壳表位LLL突变逃逸,而SPR表位诱导克隆多样性T细胞介导新冠病毒广谱保护的机制。这为深入理解T细胞对新冠病毒变异株及其他人类冠状病毒的交叉识别机制以及免疫逃逸提供了重要的理论依据,也为研发冠状病毒广谱、长效疫苗奠定了结构免疫学基础。
该研究得到国家自然科学基金、湖南省杰出青年基金等项目资助,并获得了国家同步辐射实验室上海光源的支持。
团队介绍:
南华大学衡阳医学院伍代朝教授通过与南华大学附属第一医院陈国栋教授、美国马里兰大学Roy Mariuzza、Brian Pierce教授、美国国立卫生院Nan-Ping Weng教授、上海交通大学孔旭东教授以及南华大学化工学院林英武教授合作,开展T细胞受体的免疫识别机制研究,主持国家自然科学基金面上、青年、湖南省杰青等项目,主要成果以独立第一/最后通讯作者发表在NatureCommunications(2025/2022/2020)、Science Advances(2024)、J Biol Chem(2023/2022)等自然指数期刊;获得湖南省“荷尖”人才、湖湘青年英才、湖南省卫生健康高层次人才、衡阳市优秀专家、衡阳市省级领军人才的荣誉;担任湖南省免疫学会临床免疫分会副主委,中国解剖学会组胚分会委员,湖南省解剖学会理事;主编教材1部。
原文链接:https://www.nature.com/articles/s41467-025-66322-6